
Johan Åqvist
Professor i teoretisk kemi
Wallenberg Scholar
Lärosäte:
Uppsala universitet
Forskningsområde:
Datorbaserad enzymdesign

Wallenberg Scholar
Lärosäte:
Uppsala universitet
Forskningsområde:
Datorbaserad enzymdesign
Livet på jorden frodas inte bara i tempererade klimat med god tillgång till syre och näring. Riktar vi blicken mot extrema miljöer som aktiva vulkaner eller djuphavsgravar så finns även där gott om liv.
Organismer som trivs på platser med extrem värme eller kyla, under höga tryck eller sura miljöer, kallas extremofiler. Ofta handlar det om bakterier, men även fiskar trivs trots att vattentemperaturen kan närma sig nollstrecket.
– Gemensamt för dessa är att de inte har något sätt att reglera sin kroppstemperatur, de har samma temperatur inuti sig som omgivningen. Frågan är hur deras enzymer och proteiner kan fungera under dessa extrema förhållanden, säger Johan Åqvist, professor i teoretisk kemi vid Uppsala universitet och Wallenberg Scholar.
Kroppens enzymer kan liknas vid små maskiner som håller ämnesomsättningen i gång i alla levande celler. Men hos oss människor och andra däggdjur fungerar enzymerna bara under rätt förhållanden, till exempel stannar cellens maskineri när kroppstemperaturen blir för låg.
Som Wallenberg Scholar inriktar sig Johan Åqvist mot att kartlägga skillnaderna mellan våra och extremofilernas enzymer. Och hittills har han funnit förvånansvärt få.
– Häpnadsväckande nog har de flesta skillnader vi har hittat funnits på ytan av enzymet. Små skillnader i ytstrukturen avgör om ett enzym kan fortsätta att fungera även under extrema förhållanden.
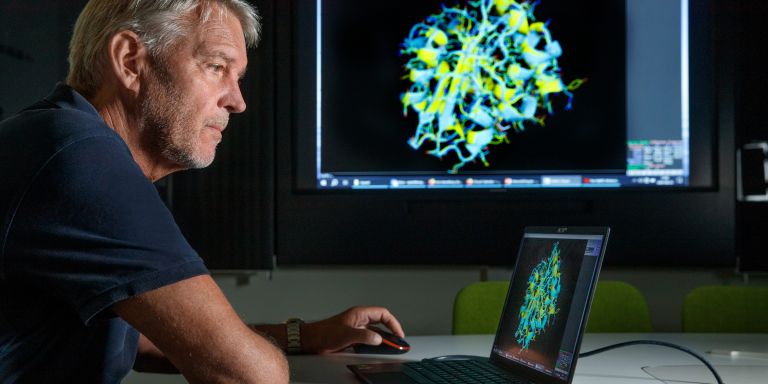
Han vänder sig till sin datorskärm för att visa bilder över ett särskilt enzym som återfinns hos två olika bakterier. Den ena bakterien är hämtad från det arktiska ishavet och den andra lever i vårt tempererade klimat. När han lägger strukturbilder av enzymet ovanpå varandra syns knappt någon skillnad mellan dem.
– Dessa två enzymer är i princip identiska, förutom på ett fåtal punkter på ytan. Förklaringen till skillnaden är att det uppstått ett antal mutationer under evolutionen som gett det köldanpassade enzymet dess nya egenskaper.
Anslaget ger mig möjligheten att verkligen förstå vad som ger olika enzym så skilda egenskaper. Och det vid en institution med en mix av kompetenser och områden som skapat en mycket fruktbar miljö.
Förenklat uttryckt har evolutionen gjort ytan på enzymet mjukare. Tack vare den mjuka ytan kan enzymet bibehålla sin funktion, eller reaktionshastighet, trots att temperaturen sjunker ned mot nollstrecket.
Reaktionshastigheten hos ett enzym styrs av en energibarriär som måste övervinnas innan enzymet kan katalysera reaktionerna i en cell. Energibarriärens storlek avgörs av mängden energi som krävs för reaktionen och hur mycket ordning som först behöver skapas i omgivningen. Två storheter som benämns med termerna entalpi och entropi. Enzymer med en mjukare yta har förmågan att skifta balansen mellan dessa storheter för att kunna fungera även under mer extrema förhållanden.
Upptäckten gjordes med hjälp av storskaliga datorsimuleringar av hur utvalda enzymer beter sig under olika förhållanden. Simuleringarna är möjliga tack vare de senaste decenniernas kartläggning av de tredimensionella atomstrukturerna hos hundratusentals olika enzymer. För att lyckas med simuleringen krävs också tillgång till den enorma beräkningskraft som finns i superdatornätverket Nationell akademisk infrastruktur för superdatorer i Sverige, NAISS.
– Med storskaliga simuleringsmetoder kan vi beräkna allt från enzymernas reaktionshastighet och bindningsstyrka till aktiveringsenergi och smälttemperatur, med mera, säger Johan Åqvist.
Simuleringarna gör det möjligt att förutsäga vilka mutationer som ligger till grund för enzymernas anpassningsförmåga. Resultatet av beräkningarna bekräftas sedan genom biokemiska experiment i labbet.
– För första gången kan vi nu förklara hur olika mutationer påverkar anpassningsförmågan hos enzymerna. Och vi är bland de första att lyckas göra det genom att simulera reaktionerna genom stora datorberäkningar. En metod som gör oss mycket snabbare än de befintliga experimentella metoderna, säger Johan Åqvist.
Området datorbaserad enzymdesign har vuxit enormt de senaste åren och är i dag ett hett forskningsområde. Att kunna skapa enzymer med nya egenskaper är viktigt inte minst inom läkemedelsindustrin som behöver nya sätt att utveckla läkemedel med större precision och på kortare tid.
Skräddarsydda enzymer kan också komma att användas till allt från framställning av biobränsle till att bryta ned olika miljögifter i naturen. Ett mer vardagsnära exempel är att framställa tvättmedel som är lika effektiva i kallt som varmt vatten.
Johan Åqvist var bland de första i Sverige att utveckla beräkningsmetoder inom området molekyldynamik. Redan under sin doktorandtid på 1980-talet arbetade han med metoder att beräkna reaktionshastigheten hos enzymer utifrån deras tredimensionella struktur. Fortfarande drivs han av lika delar nyfikenhet och vilja att bidra till utvecklingen av nya teknologier.
– I dag vill jag förstå vad evolutionen gjort för att få detta att fungera. Dessutom vill jag bidra till möjligheten att designa enzymer med unika egenskaper.
Text Magnus Trogen Pahlén
Foto Magnus Bergström